Notre science
Deux plateformes — « V-Body » et « Integrative Chemistry » — pour un ciblage thérapeutique précis et ePicace.
Approche
Besoins médicaux non satisfaits
Malgré les avancées majeures dans le traitement des maladies graves, plus de 30 % des patients dans le monde n’ont toujours pas accès à des solutions thérapeutiques efficaces, laissant des millions de personnes sans soins adaptés. Les traitements actuels rencontrent encore des limites en termes d’efficacité et de tolérance, en raison d’une pénétration tissulaire limitée, en particulier pour les maladies complexes qui résistent aux approches conventionnelles.
Chez Valerio Therapeutics, nous développons la prochaine génération de thérapies ciblées de précision pour relever ces défis dans trois domaines clés :
- Les maladies immuno-inflammatoires et auto-immunes, touchant près de 10 % de la population mondiale, soit plus de 800 millions de personnes. Des maladies telles que la polyarthrite rhumatoïde, le lupus et la maladie de Crohn restent diPiciles à traiter de manière durable.
- Les maladies métaboliques rares, impactant plus de 300 millions de patients dans le monde, avec plus de 7 000 maladies rares identifiées. Plus de 90 % de ces maladies n’ont pas de traitement approuvé, laissant les patients avec des options extrêmement limitées.
- Les tumeurs solides, qui représentent 90 % des nouveaux cas de cancer et causent plus de 10 millions de décès par an. De nombreux cancers avancés restent résistants aux thérapies actuelles, y compris les immunothérapies conventionnelles.
Grâce à des plateformes technologiques de pointe et un engagement fort en matière d’innovation, Valerio Therapeutics repousse les frontières de la médecine pour oPrir des solutions thérapeutiques plus efficaces, ciblées et durables.
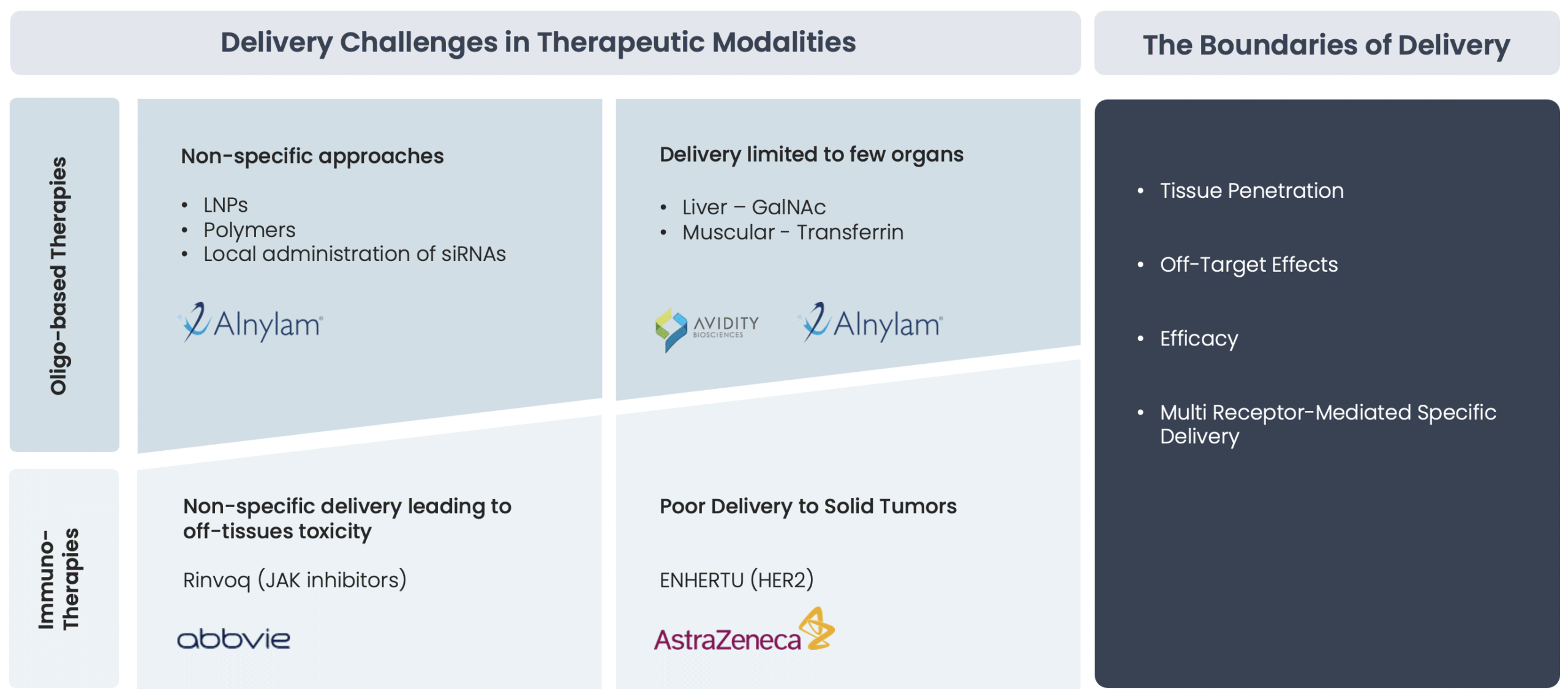
L’adressage thérapeutique ciblée spécifique des tissus : un défi majeur impactant efficacité et tolérance
L’un des plus grands défis des thérapies ciblées actuelles est l’adressage efficace et précis des molécules thérapeutiques aux tissus profonds. Les anticorps monoclonaux conventionnels et autres produits biologiques de grande taille rencontrent souvent des diPicultés à pénétrer ePicacement, tandis que les médicaments à petites molécules peuvent souPrir d’une spécificité limitée et de toxicité hors cible. Ces limitations entraînent :
- Réduction de l’eXicacité thérapeutique : pénétration incomplète des produits biologiques et interaction sous-optimale des petites molécules avec leurs cibles.
- Exposition systémique accrue : des doses plus élevées sont souvent nécessaires, entraînant une toxicité potentielle et des ePets indésirables.
- Mécanismes de résistance : de nombreux cancers avancés et maladies chroniques développent une résistance en raison de la mauvaise distribution du médicament et de l’absence d’adressage précis.
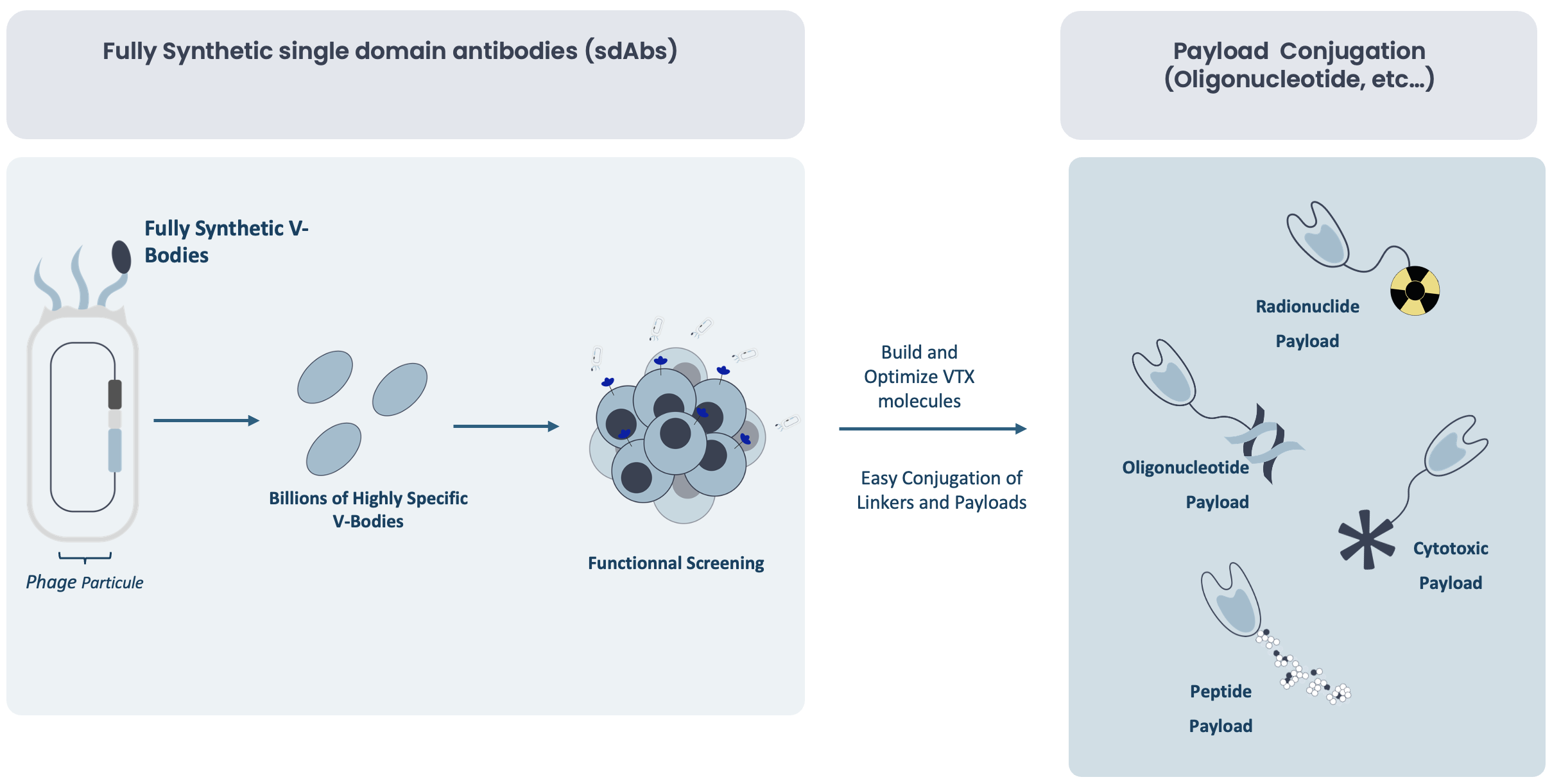
Combinaison unique d’anticorps à domaine unique avec la chimie des linkers et des charges thérapeutiques (payloads).
Chez Valerio Therapeutics, nous avons développé une approche ciblée de précision qui intègre des produits biologiques de pointe (plateforme V-Body) et une chimie innovante (technologie des linkers et payloads) pour répondre à ces défis. Notre plateforme V-Body, fondée sur des anticorps à domaine unique compacts (~15 kDa), permet une pénétration tissulaire inégalée. Parallèlement, notre chimie de linkers et payloads de dernière génération permet une conjugaison de médicaments sur mesure et une libération optimisée au site cible.