我们的科学
我们的科学
平台
platON™ 是我们的专有化学平台,基于诱饵寡核苷酸库,可产生作用于细胞内 DNA 结合靶标的破坏性化合物。
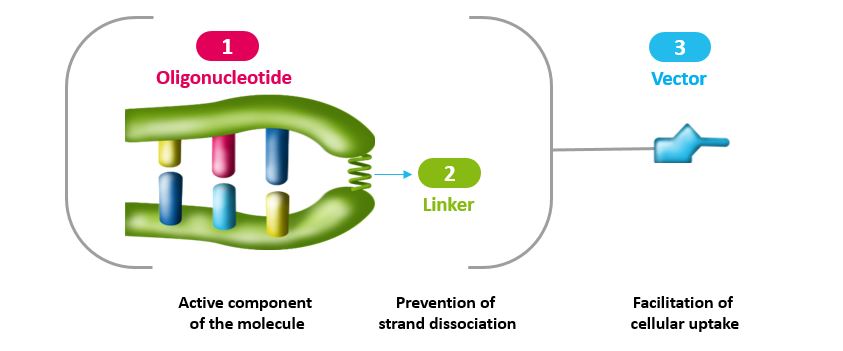
platON™ 是一个强大且多功能的平台,它使用三个组件:双链寡核苷酸序列、连接体以及(如果适用)细胞摄取促进剂。 这三种成分中的每一种都可以进行修饰,以产生表达不同特性和/或活性的各种化合物,其共同特征是通过具有激动剂作用的诱饵机制靶向肿瘤DNA修复途径。
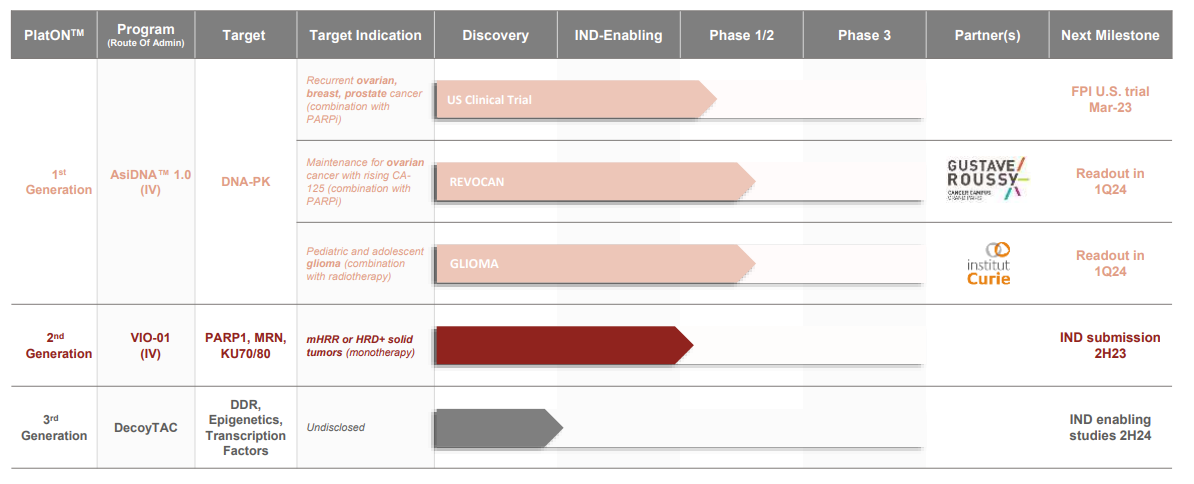
platON™ 已经产生了两种非常创新的分子:AsiDNA™ 和 VIO-01
开发中
DDR靶向分子

AsiDNA™ 是一种短双链 DNA 片段(寡核苷酸),充当诱饵并模仿肿瘤细胞 DNA 中的双链断裂。 AsiDNA™ 分子触发错误的 DNA 断裂信号,以激活和吸引 DNA 修复蛋白,从而防止它们招募到实际 DNA 损伤的部位。 结果,肿瘤细胞 DNA 的损伤仍未修复。 由于癌细胞失去了调节细胞分裂的能力,它们将带着受损的DNA继续分裂,最终导致癌细胞死亡。
早期研究表明 AsiDNATM:
不会引起耐药性并逆转对其他治疗的耐药性
所有的靶向治疗都面临着获得性耐药的现象。 AsiDNA™ 作用于重要的双链断裂修复途径的上游,防止肿瘤细胞使用另一种蛋白质来抵抗其作用,从而不会引起任何抵抗。
AsiDNA™ 还展示了联合使用时能够阻止甚至对抗其他靶向治疗(例如 PARPi)的耐药性。
使用越多越有效
AsiDNA™ 促进、过度激活和转移肿瘤细胞生存所必需的自然生物过程,该过程无法停止,并且随着细胞耗尽对 DNA 损伤的反应能力而变得越来越有效。
VIO-01 是 Valerio 专有 DNA 诱饵疗法平台的第二个候选药物,旨在成为下一代泛 DDR DNA 诱饵。
虽然 PARP 抑制剂在癌症治疗方面取得了重大进展,但该类药物仍然存在一些限制因素,特别是耐药性的快速出现。 作为下一代泛 DDR DNA 诱饵,VIO-01 旨在消除多种 DNA 修复途径,并通过 STING 途径激活先天免疫反应,从而引发强大的免疫反应。 STING 通路在检测 DNA 异常和激活免疫系统瞄准并摧毁癌细胞方面发挥着关键作用。
VIO-01 目前正在单独进行概念验证以及与癌症免疫疗法联合进行 IND 临床前研究。
有关 VIO-01 的更多信息,请参阅我们在 2020 年 PARP 和 DDR 抑制剂峰会上的演示以及我们在 2023 年 AACR 虚拟会议上的摘要。
DecoyTAC 分子
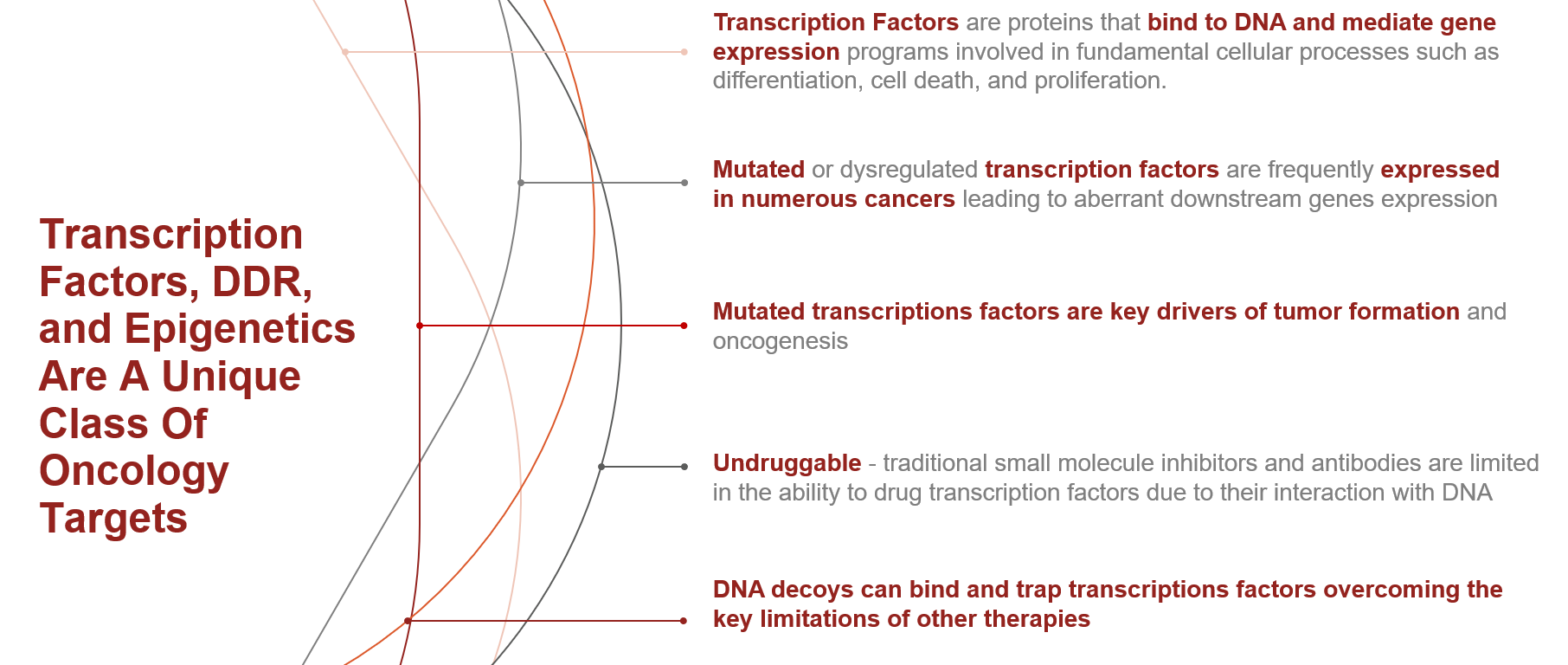
DecoyTAC – 靶向致癌 DNA 相互作用蛋白(例如转录因子)
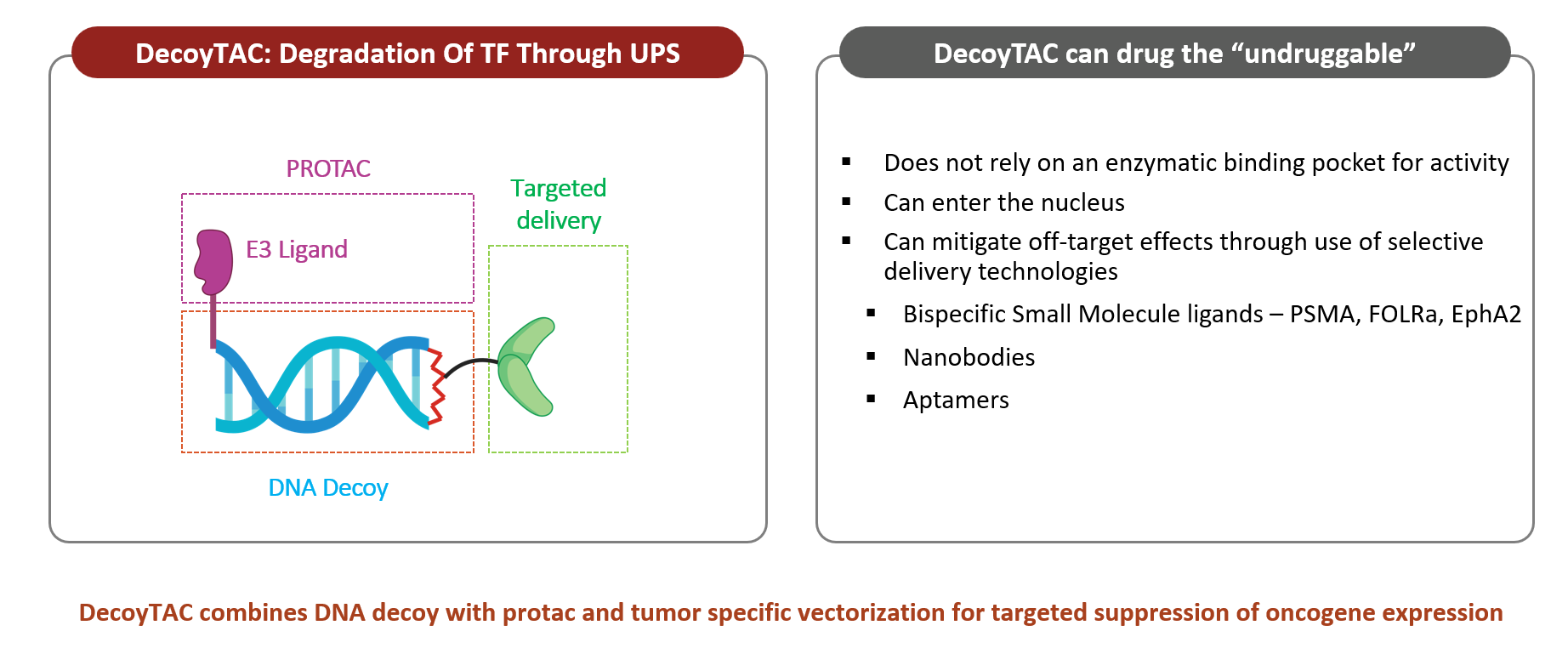
DecoyTAC的作用机制
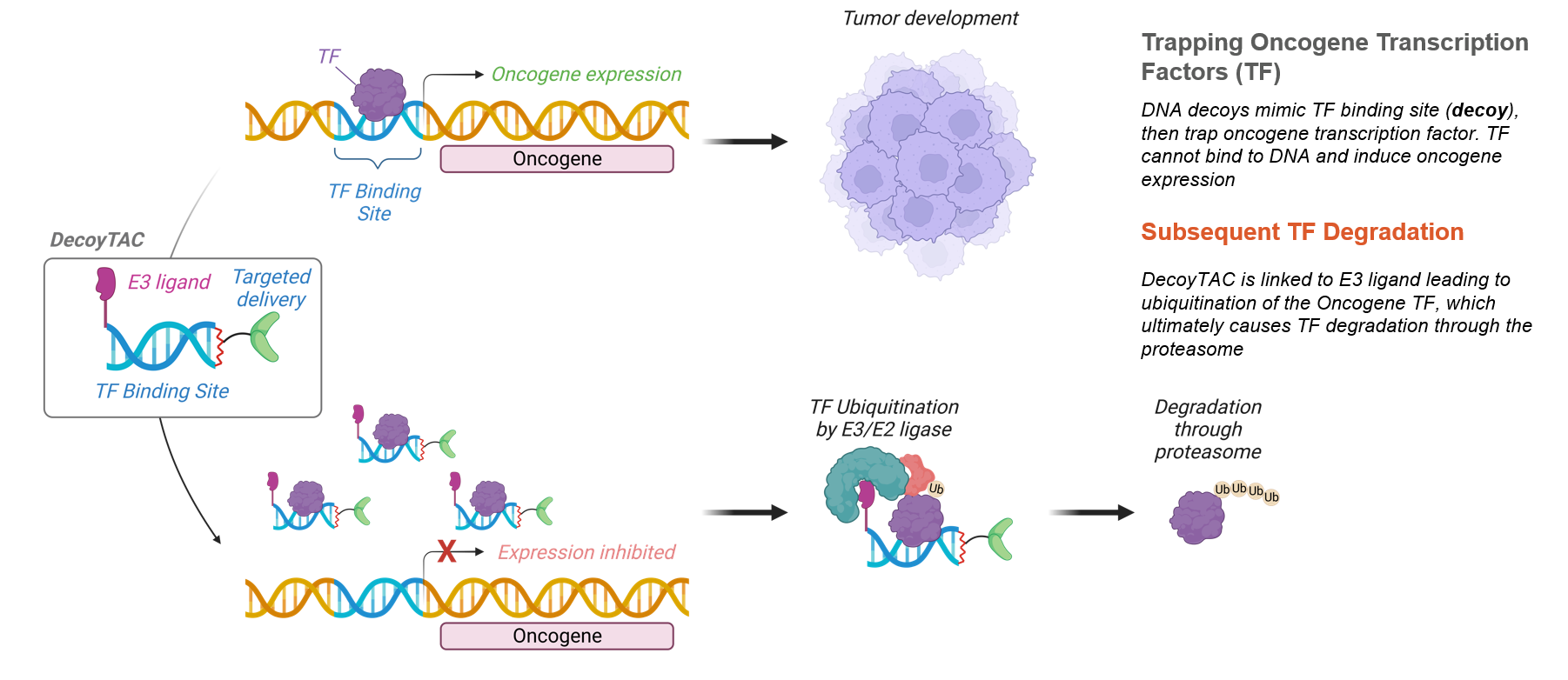
成功

Belinostat 是一种组蛋白脱乙酰酶抑制剂 (HDACi)。 多项临床试验已对其作为单独治疗(单一疗法)或与其他抗癌治疗联合治疗血液癌症和实体瘤进行了评估。 其抗癌活性与抑制细胞增殖、诱导细胞凋亡(程序性细胞死亡)、抑制血管生成和诱导细胞分化有关。
Beleodaq®是注射用belinostat的商业名称。
Beleodaq® 自 2014 年起由 Spectrum Pharmaceuticals (SPPI) 在美国上市,并于 2014 年 7 月获得 FDA 有条件批准。
2019年3月,Aurobindo Pharma 的全资子公司 Acrotech Biopharma LLC 从 Spectrum Pharmaceuticals (SPPI) 获得了 belinostat 在某些地区的许可,包括美国、加拿大、墨西哥和印度。 2020 年 4 月,Valerio Therapeutics 向 Acrotech 授予了所有其他地区 belinostat 的免版税许可,并转让与所有形式的 belinostat 相关的某些知识产权和专有技术。 作为本次交易的一部分,Valerio Therapeutics 与 Pint Pharma 在南美洲的许可协议,以及与 Clinigen plc 和 iQone 在欧洲国家的指定患者项目的合同及相关协议也已转让给 Acrotech。
此次交易完成了 Valerio Therapeutics 向一家专注于肿瘤学 DNA 损伤反应 (DDR) 领域开发活动的公司的转型。
为什么要针对 DNA 损伤反应来对抗癌症?
针对 DNA 损伤反应(DDR)的治疗方法是肿瘤学中一个相对较新的领域。 2015 年诺贝尔化学奖授予三名研究 DNA 修复机制的研究人员,科学界对它的重要性表示认可。 诺贝尔奖共同获得者 Tomas Lindahl 教授担任 Valerio 治疗科学委员会主席。 抑制肿瘤细胞中的 DNA 修复机制如今被认为是治疗癌症最有前途的方法之一。
它基于这样一个事实:癌细胞会由于不受控制的增殖或化疗或放疗等治疗而积累 DNA 断裂。 由于无法利用受损的 DNA 进行复制,它们的生存高度依赖于 DNA 修复机制,该机制会激活一系列复杂的蛋白质检测、信号传导和修复断裂。 当这些机制受损时,癌细胞就会失去修复 DNA 的能力,当它们试图用受损的 DNA 进行复制时,就会导致癌细胞死亡。
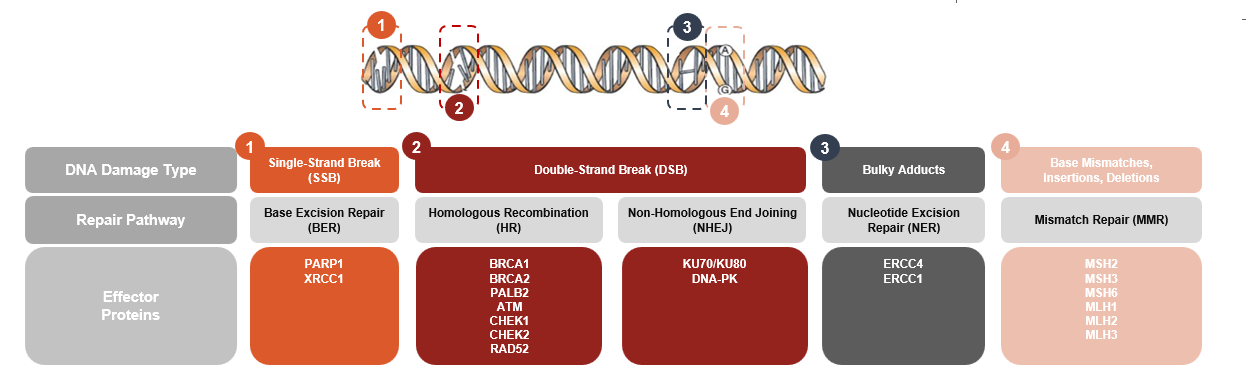
DNA 损伤反应 (DDR)
DNA 损伤反应是一系列复杂的细胞事件,可以非常简单地概括为三个阶段:
- 使用“传感器”蛋白(例如 PARP)检测和识别损伤。
- 通过“转导”蛋白(例如 DNA-PK、ATR 等)发出信号,其作用对于协调最适当的反应、修复 DNA 断裂或破坏细胞(如果损伤过于广泛)至关重要。
- 使用 RAD、POLQ 等效应蛋白进行修复,这些蛋白将适当修复 DNA 分子(切除、复制、插入等)
靶向 DNA 损伤反应 (DDR) 来治疗癌症
- DNA 修复过程是一种被激活以恢复基因组完整性的分子机制
- 癌细胞中发现的基因突变可能导致一种或多种 DNA 修复途径功能丧失,导致细胞过度依赖其余途径
- 抑制剩余的修复途径(合成致死性)会导致 DNA 进一步受损,将单链断裂转变为双链断裂并引发细胞死亡
- 市场上已有五种 PARP 抑制剂(碱基切除修复机制),产生 >$3.5B (2022):olaparib (AZ)、niraparib (GSK)、rucaparib (Clovis Oncology)、pamiparib (BeiGene) 和 talazoparib (Pfizer)
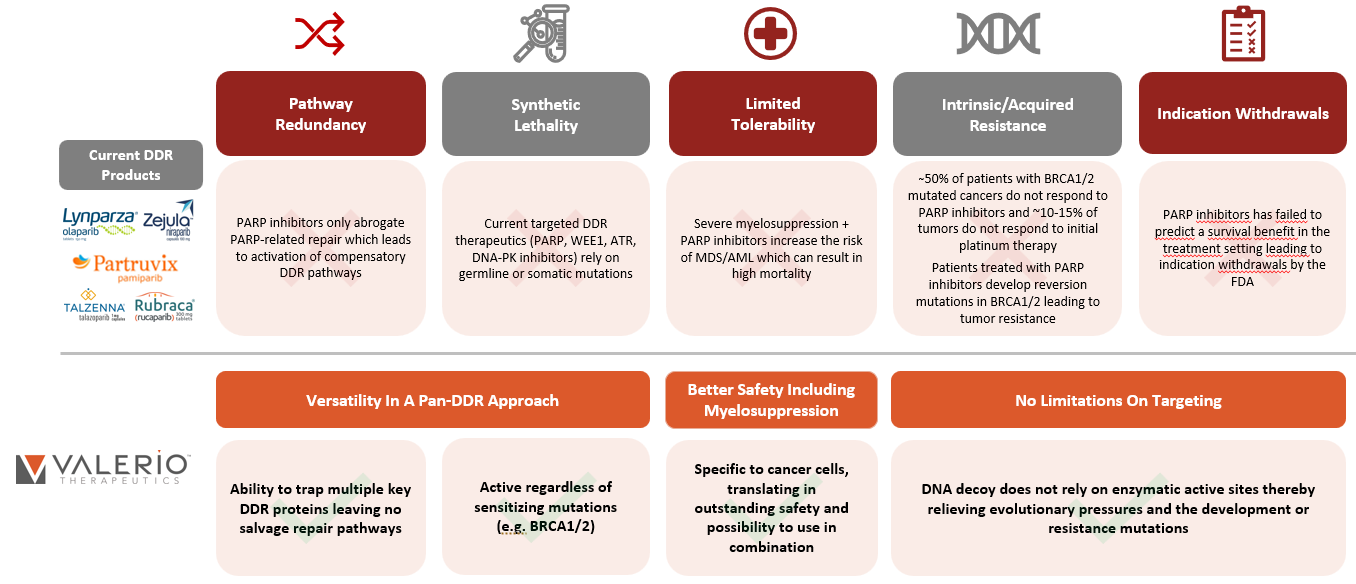
解决当前 DDR 疗法的严重局限性